铜绿假单胞菌快速检测方法的优化研究
单 萌1,周 婀1,马 瑜2*
(1.上海康识食品科技有限公司,上海 201101;
2.陕西省微生物研究所,陕西西安 710043)
摘 要:为优化铜绿假单胞菌检测方法,本研究对不同选择性培养基的筛选效力及选择性进行了评价,并按照GB 8538—2016对人工污染样品进行了检验;进而,将选择性培养基鉴定结果与VITEK 2 Compact全自动细菌鉴定系统和基质辅助激光解析电离飞行时间质谱技术(MALDI-TOF-MS)结合,对不同检测技术、方法的有效性、适用性及相互之间的融合性进行了比较和分析,以期提升铜绿假单胞菌的检测效率及准确度。结果表明,乙酰胺琼脂上铜绿假单胞菌的特异性较差,会出现假阳性或假阴性结果;而铜绿假单胞菌显色培养基(RAPID’s P.aeruginosa Agar)则具有典型的菌落特征以及较短的增菌时间,因此,将该培养基与VITEK 2 Compact系统结合使用可有效提高检测的灵敏度、特异性及时效性,适用于对大批量样品进行快速判定。
关键词:铜绿假单胞菌;快速检测方法;优化
Comparison and Optimization of the Rapid Detection Method for Pseudomonas Aeruginosa
SHAN Meng1, ZHOU E1, MA Yu2*
(1.MasterKong CO., Ltd., Beverage IRD Center,Shanghai 201101,China;2.Shaanxi Institute of Microbiology, Xi'an 710043, China)
Abstract: In order to optimize the detection method for Pseudomonas aeruginosa, comparison of the effectiveness and selectivity of different selective media was performed, and the artificially contaminated samples were tested according to the GB 8538—2016. Finally, for the purpose of improving the detection efficiency and accuracy of P.aeruginosa, the results obtained above were combined with the VITEK 2 Compact and MALDI-TOF MS Biotyper System. The effectiveness, applicability and integration of the three detection methods were compared and analyzed. The results showed that the specificity of acetamide agar for Pseudomonas aeruginosa was poor, and accompanied with false positive/negative results occasionally. However, the RAPID’s P.aeruginosa Agar was notable for its typical colony characteristics and short incubation time. Therefore, the combination of RAPID’s P.aeruginosa Agar with the technique of VITEK 2 Compact System was suitable for rapid determination of large quantities of samples with the , which can improve the sensitivity, specificity and timeliness of the detection remarkably.
Keywords: ; rapid detection method; optimization
铜绿假单胞菌(),属假单胞菌属,广泛分布于水、土壤、空气、植物、污水、医院、动物及人体内等各类环境中,是一种常见的水源性和食源性条件致病菌[1-3]。该菌可引起机体组织器官病变甚至坏死,进而引起肠胃炎、败血症等病症及不同程度的人畜共患性传染病;同时,其产生的多种致病因子容易引起免疫力低下及受抑制人群或长期使用抗生素人群的化脓性感染和耐药性问题[4-5]。此外,铜绿假单胞菌形成生物膜后,对干燥、紫外线、消毒剂等理化因素及不良环境具有较强的抵抗力;且由该菌污染引起的产品腐败会严重影响产品品质,导致经济损失。因此,实现铜绿假单胞菌准确、快速检测一直是食品加工业的关注重点和迫切需求[6]。
利用培养基对微生物菌群中特定微生物具有选择性的这一特征,可以通过不同的选择性培养基从环境中对微生物进行分离。而关于铜绿假单胞菌的检测主要依赖于培养方法,其中最为关键的是选择合适的培养基。目前,已有多种选择性培养基,如抗生素筛选培养基[7]、色素筛选培养基[8]及乙酰胺培养基[9]可用于假单胞菌的分离筛选。我国关于铜绿假单胞菌的检测大多依据GB 7918.4—1987[10]和
GB 8538—2016[11],此外,国标GB 19298—2014中明确规定各类抽检水样品中均不得检出铜绿假单胞菌[12]。但上述标准中的检测方法主要依赖于传统的分离培养、形态学观察及生化鉴定等检测手段,检测耗时长、过程烦琐、且容易出现假阳性或假阴性结果,不利于企业快速判断结果,进而造成检测结果滞后。因此,实现铜绿假单胞菌的快速、准确检测具有重要意义。
随着人们生活水平和对健康意识的不断提高,包装饮用水成为了许多家庭和集体饮用水的首选。近年来,随着包装饮用水的消费数量的不断上升、产品种类及包装方式的多元化,包装饮用水中检出铜绿假单胞菌的报道逐渐增多,原有的传统检测方法已难以满足当前的生产需求[13]。本研究同时对用于铜绿假单胞菌检测的4种不同培养基的筛选效力及选择性进行了评价,进而通过将选择性培养基鉴定结果与VITEK 2 Compact全自动细菌鉴定系统和基质辅助激光解析电离飞行时间质谱技术(MALDI-TOF-MS)结合,对不同检测技术、方法的有效性、适用性及相互之间的融合性进行了比较和分析,以期提升铜绿假单胞菌的检测效率及准确度。
1 材料与方法
1.1 材料与仪器
标准菌株共 5 株, 包 括: 铜 绿 假 单 胞 菌(Pseudomonas aeruginosa)ATCC27853(N-1)、 大肠埃希氏菌(Escherichia coli)ATCC25922(N-2)、荧光假单胞菌(Pseudomonas fluorescens)ATCC13525(N-3)、 嗜 麦 芽 寡 养 单 胞 菌(Stenotrophomonasmaltrophilia)ATCC51331(N-4)、鞘氨醇单胞菌属(Sphingobacterium)ATCC31555(N-5),为广东微生物菌种保藏中心保藏菌种。其中,铜绿假单胞菌N-1 (P. aeruginosa)ATCC27853 作为阳性对照,其余菌株为阴性对照。G-1(铜绿假单胞菌,P.aeruginosa)、G-2( 铜 绿 假 单 胞 菌,P.aeruginosa)、G-3( 铜 绿假单胞菌,P.aeruginosa)、G-4(恶臭假单胞菌,Pseudomonas putida)、G-5(少动鞘氨醇单胞菌,Sphingomonaspaucimobilis)为本实验室保存菌株,乙酰胺实验结果均呈阳性。其中,G-1、G-2、G-3 分离自水源水,G-4、G-5 分离自产品水。
营养琼脂、假单胞菌琼脂基础培养基 /CN 琼脂、平板计数培养基 /PCA 琼脂、乙酰胺培养基、乙酰胺肉汤(广东环凯微生物科技有限公司);RAPID’P.aeruginosa Agar(BIO-RAD)。
VITEK 2 Compact 30 全自动细菌鉴定及药敏分析系统(梅里埃);基质辅助激光电离解析飞行时间质普(MALDI-TOF MS Biotyper System)(布鲁克);1 ~ 1000 μL 移液器(Eppendorf);LDZX-50KBS 型立式压力蒸汽灭菌器(上海申安);VORTEX-6 涡旋振荡仪(其林贝尔)。
1.2 试验方法
1.2.1 菌株活化
将-80 ℃保存的5株标准菌株与5株实验室保存菌株划线接种于营养琼脂平板上,于36 ℃培养24 h,连续传代2次,得到活化菌株[14]。
1.2.2 不同选择培养基特异性比较
(1)特异性比较。将10株菌株分别划线接种在营养琼脂、CN琼脂、乙酰胺培养基、RAPID’s P.aeruginosa Agar4种培养基上,36 ℃培养24 h,比较4种培养基对试验菌株的特异性。
(2)适用性比较。将10株菌株制成不同浓度(10-2~10-6 CFU)的菌悬液,按照GB 8538—2016的方法对水样进行过滤,将滤膜转至营养琼脂、CN琼脂、乙酰胺培养基、RAPID’s P.aeruginosa Agar4种培养基上,36 ℃培养24 h,观察比较对试验菌株在4种培养基上的生长状况及显色反应。
1.2.3 人工模拟污染试验
如表1所示,将2~4种菌混合,制备成10-1 CFU的混合菌悬液,梯度稀释至10-5 CFU,取0.2 mL菌液加入250 mL模拟水样中,按照GB 8538—2016的方法对水样进行过滤,将滤膜转至乙酰胺培养基及RAPID’s P.aeruginosa Agar,36 ℃培养24 h,观察、比较两种培养基的检验效果。

1.2.4 VITEK 2 Compact全自动细菌鉴定及药敏分析系统鉴定方法
将活化后的菌株进行革兰氏染色,于光学显微镜下观察菌体形态及染色结果,根据染色结果和菌体形态选择相应的鉴定卡。用一次性接种环挑取待测菌株单菌落至含3 mL 0.45% NaCl溶液的一次性悬浮试管中,调节麦氏浓度至0.5~0.6左右,填充对应鉴定卡,采用VITEK 2 Compact全自动细菌鉴定及药敏分析系统进行系统鉴定。
1.2.5 基质辅助激光电离解析飞行时间质谱(MALDI-TOF MS Biotyper System)鉴定方法根据MALDI-TOF MS Biotyper System操作规程,用一次性接种环挑取新鲜待测菌株单菌落涂布于MALDI靶板,滴加1 μL浓度为70%的甲酸溶液,室温下晾干,覆盖1 μL基质液,室温下自然晾干后上机测定。
1.3 数据处理
MALDI-TOF鉴定结果用Biotyper 3.1 database分析;其余结果采用Excel 2007进行数据统计和分析。
2 结果与分析
2.1 不同选择培养基特异性比较
2.1.1 特异性比较
10株菌株在4种培养基上培养24 h后的生长状况如表2所示。由表2可知,在营养琼脂、CN琼脂及乙酰胺琼脂培养基上,铜绿假单胞菌菌落无法与其他的假单胞菌和大肠菌群区分开来;在RAPID’s P.aeruginosa Agar上,铜绿假单胞菌呈现蓝绿色,其他菌种在该培养基上不生长或菌落颜色呈白色或淡黄色,可有效、快速的区分铜绿假单胞菌与其他菌群。
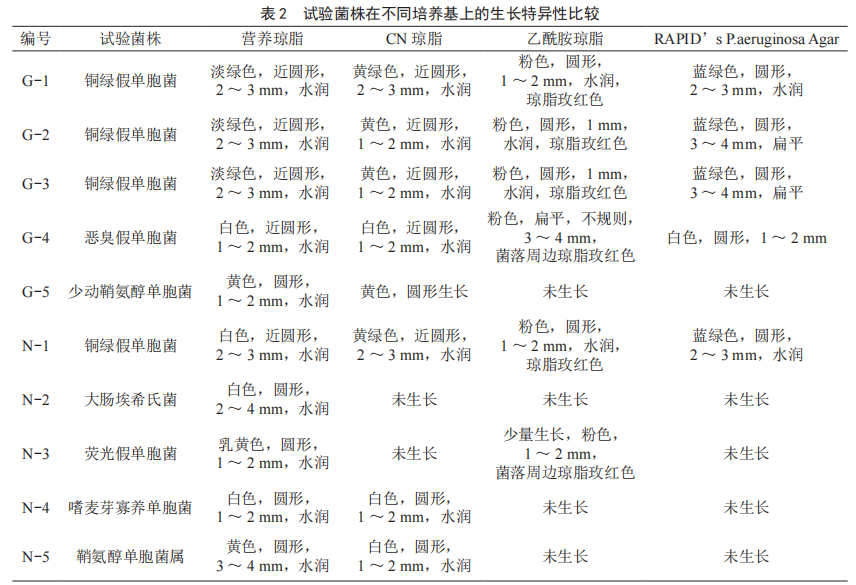
2.1.2 适用性比较
由表3可知,通过不同菌浓度的试验可知,膜片上高浓度铜绿假单胞菌可能会使乙酰胺培养基呈玫红色,低浓度铜绿假单胞菌不一定会使培养基呈玫红色;标准菌株显色效果要优于从水源水中检出铜绿假单胞菌;此外,恶臭假单胞菌可使乙酰胺培养基变色呈玫红色。因此,实际操作中在乙酰胺培养基上无法直接有效区分铜绿假单胞菌与其他的菌落。不同菌浓度样品的滤膜在RAPID’s P.aeruginosa Agar上表现一致,铜绿假单胞菌呈蓝绿色,其他菌种在该培养基上不生长或菌落颜色呈白色或淡黄色。因此,如使用滤膜法进行铜绿假单胞菌的检测,若使用乙酰胺培养基进行筛选,有可能会造成结果假阴性或假阳性的出现。而在RAPID’s P.aeruginosa Agar上的试验,滤膜法与直接划线法结果一致。

2.2 人工模拟污染试验分析
RAPID’s P.aeruginosa Agar上,铜绿假单胞菌呈蓝绿色,干扰菌不生长或呈白色,其他菌不会干扰其在膜片上的生长;而乙酰胺培养基上不能分辨出铜绿假单胞菌与其他菌落。
2.3 VITEK 2 Compact全自动细菌鉴定系统鉴定结果
所有菌株均为革兰氏阴性菌株,VITEK 2 Compact全自动细菌鉴定系统鉴定结果见表4。VITEK 2 Compact全自动细菌鉴定系统对5株标准菌株的鉴定结果符合率为100%,其余5株保存菌株中G-1(99%)、G-2(98%)、G-3(99%)鉴定为铜绿假单胞菌。10株菌株中阳性菌株为4株,阴性菌株为6株,4株铜绿假单胞菌全部被检出。

2.4 基质辅助激光电离解析飞行时间质普(MALDI-TOF MS)鉴定结果
10株菌经MALDI-TOF MS鉴定得到的结果与VITEK 2 Compact全自动细菌鉴定所得鉴定结果一致,如表4所示。
2.5 铜绿假单胞菌检验方法的优化及验证
结合人工模拟污染试验与两种不同鉴定系统的检验结果,对铜绿假单胞菌检验方法进行适当优化,如图1所示。优化后的检验程序主要分为两部分:①参考GB 8538—2016的方法对水样进行过滤,将滤膜转至RAPID’s P.aeruginosa Agar培养基上,36 ℃培养22~30 h;②利用VITEK 2 Compact全自动细菌鉴定系统对RAPID’s P.aeruginosa Agar平板上典型蓝绿色菌落进行鉴定。以检验程序两部分的结果均为阳性时,判定为铜绿假单胞菌,其余结果为阴性。

采用优化后的方法对1.2.3中的人工模拟污染试验水样进行验证试验,结果如图2所示。优化后的方法在快速识别铜绿假单胞菌与其他干扰菌(呈白色)的同时,实现了疑似菌落的快速鉴定。所得鉴定结果与传统鉴定方法一致。

3 结论与讨论
铜绿假单胞菌作为一类致病性较低但耐药性强的细菌,可以长期在水环境中生存,是水质监测的重要指标之一。随着铜绿假单胞菌污染饮用水及耐药性等问题的逐渐突出,选择适合生产企业的简便、准确、高效的快速检测方法,已成为当前产业界和保障人们金博宝188官网注册的迫切需求。现有国标中使用的传统方法涉及滤膜过滤、微生物培养观察鉴别及验证、氧化酶试验、产氨试验等,由于试验过程操作烦琐、工作量大、成本高且耗时长,已难以满足当前金博宝188官网注册生产的需求。而针对假单胞菌的选择性的开发是一个长期的挑战。此外,不同检测技术(或方法)的有效性、适用性及相互之间的融合性也成为了提升检测效率和质量的关键。随着微生物快速检测技术的不断进步,VITEK 2 Compact全自动细菌鉴定系统和基质辅助激光解析电离飞行时间质谱技术(MALDI-TOF-MS)已被广泛用于常规试验微生物,特别是铜绿假单胞菌的检测与鉴定[15-17]。
为快速、有效地区分铜绿假单胞菌与其他干扰菌,本研究通过对不同选择性培养基检测效果进行比较发现,乙酰胺琼脂上铜绿假单胞菌的特异性较差,会出现假阳性或假阴性结果,而铜绿假单胞菌显色培养基(RAPID’s P.aeruginosa Agar)凭借其典型的菌落特征以及较短的增菌时间,适合对大批量样品进行快速判定。VITEK 2 Compact全自动细菌鉴定系统及其所携带的分析系统可在快速完成菌种鉴定的同时对获得数据结果进行分析,操作过程安全、快速、准确、重复性好[18-19]。目前,该系统已被应用于中华人民共和国国家标准中关于沙门氏菌、单增李斯特氏菌和副溶血性弧菌的检验过程中[20-22]。但是,在日常检验工作中按照GB 8538—2016方法和GB 7918.4—1987方法检测得到的部分阳性菌株在采用VITEK 2 Compact系统进行鉴定时会有一定概率呈现假阳性或假阴性结果,从而会对实际生产中的水质鉴定结论产生误导。推测其原因在于部分样品中的阳性菌株在培养过程中因其细胞代谢产物理化性质的差异导致了VITEK 2 Compact系统中个别生化显色反应的变化从而导致系统的误判。因此,在采用VITEK 2 Compact系统进行鉴定时,使用快速有效的特异性显色培养基培养作为对照以减少假阳性或假阴性误差是十分必要的。
此外,基质辅助激光电离解析飞行时间质普(MALDI-TOF MS)因其对致病菌识别速度快等优势也在微生物检测领域得到了推广应用。崔学文等[23]应用MALDI TOF MS对不同来源的15株铜绿假单胞菌及8株干扰菌进行鉴定,所得鉴定结果于VITEK完全一致。李进等[24]利用MALDI TOF MS对VIM型和SPM型金属酶铜绿假单胞菌进行检测分析,MALDI-TOF MS对25株VIM型菌株灵敏度为92.0%,对于20株SPM型菌株灵敏度为80.0%,所得结果比常规PCR技术更有优势。但是,由于MALDI-TOF MS具有极高的灵敏度,为避免试验误差影响,对于试验所用的耗材、标准溶剂以及试验器具的质量要求较高。同时,由于该检测需要涉及使用专业计算机软件对所得质量图谱与标准菌株图谱库进行比对鉴定和各种数据的聚类分析,因此对于检测人员的技术和业务素养要求也较高。再加之整套系统的设备成本,使得该方法目前还难以在广大的中小企业中得以普及应用。
因此,铜绿假单胞菌显色培养基(RAPID’s P.aeruginosa Agar)凭借其典型的菌落特征以及较短的增菌时间,将该培养基与VITEK 2 Compact系统结合使用可有效提高检测效率、准确率、特异性及时效性,适用于对大批量样品进行快速判定。但考虑到本研究所采用的试验检测样本来源和数量的局限性,这一方法还需通过后续对大量实际样本的检测应用来积累数据,以期为我国的饮用水安全保障事业提供技术支持。
参考文献
[1]Morrison A J,Wenzel R P.Epidemiology of infections due to Pseudomonas aeruginosa[J].Clin Infect Dis,1984,6:S627-S642.
[2]Stover C K,Pham X Q,Erwin A L,et al.Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen[J].Nature,2000,406:959-964.
[3]Hesse C,Schulz F,Bull C T,et al.Genome-based evolutionary history of Pseudomonas spp[J].Environ Microbiol,2018,20(6):2142-2159.
[4]Kerr K G,Snelling A M.Pseudomonas aeruginosa:a formidable and ever-present adversary[J].J Hosp Infect,2009,73(4):338-344.
[5]Gomez M,Prince A.Opportunistic infections in lung disease: Pseudomonas infection in cystic fibrosis[J].Current Opinion in Pharmacology,2007,7(3):244-251.
[6]Jimenez S.A review of reported recalls involving microbiological control 2004-2011 with emphasis on FDA considerations of ‘objectionable organisms’[J].American pharmaceutical review,2012,15:42-57.
[7]美国食品与药品管理局.细菌学分析手册[M].北京:中国轻工业出版社,1986.
[8]Smith R F,Dayton S L.Use of acetamide broth in the isolation of Pseudomonas aeruginosa from rectal swabs[J].Applied Microbiology,1972,24(1):143-145.
[9]Szita G,Gyenes M,Soós L,et al.Detection of Pseudomonas aeruginosa in water samples using a novel synthetic medium and impedimetric technology[J].Letters Applied Microbiology,2007,45:42-46.
[10]卫生部.化妆品微生物标准检验方法 绿脓杆菌:GB 7818.4—1987[S].北京:中国标准出版社,1987.
[11]国家卫生和计划生育委员会,国家食品药品监督管理总局.金博宝188官网注册 国家标准 饮用天然矿泉水检验方法:GB 8538—2016[S].北京:中国标准出版社,2016.
[12]中华人民共和国国家卫生和计划生育委员会.金博宝188官网注册 国家标准 包装饮用水:GB 19298—2014[S].北京:中国标准出版社,2014.
[13]黄茜,刘艳,尹佳,等.包装饮用水中铜绿假单胞菌污染状况调查研究[J].中国卫生检验杂志,2019,29(15):1890-1892.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[15]杨晶,王伟欢.VITEK 2 Compact系统的应用及鉴定结果分析[J].中国卫生检验杂志,2016,26(18):2643-2645.
[16]Pereira F D,Bonatto C C,Lopes C A,et al.Use of MALDI-TOF mass spectrometry to analyze the molecular profile of Pseudomonas aeruginosa biofilms grown on glass and plastic surfaces[J].Microbial Pathogenesis,2015,86:32-37.
[17]杨明,涂凤琴,胡筱静,等.铜绿假单胞菌检测方法研究进展[J].食品工业科技,2019,40(19):345-352.
[18]张帆,李树垚,张子豪,等.铜绿假单胞菌检测方法的比较与优化[J].生物技术通报,2018,34(3):67-74.
[19]郭瑞军.VITEK 2 Compact及其在食品微生物检测中的应用研究[J].现代食品,2020,12(65):192-201.
[20]国家卫生和计划生育委员会,国家食品药品监督管理总局.金博宝188官网注册 国家标准 食品微生物学检验 沙门氏菌检验:GB 4789.4—2016[S].北京:中国标准出版社,2016.
[21]国家卫生和计划生育委员会,国家食品药品监督管理总局.金博宝188官网注册 国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验:GB 4789.30—2016[S].北京:中国标准出版社,2016.
[22]国家卫生和计划生育委员会.金博宝188官网注册 国家标准 食品微生物学检验 副溶血性弧菌检验:GB 4789.7—2013[S].北京:中国标准出版社,2013.
[23]崔学文,罗慧萍,李增婷,等.基质辅助激光解吸附电离飞行时间质谱在铜绿假单胞菌鉴定中的应用[J].现代预防医学,2016,43(10):1862-1867.
[24]李进,黎敏,鲁卫平.MALDI-TOF MS技术对VIM型和SPM型金属酶铜绿假单胞菌的检测分析[J].第三军医大学学报,2020,42(16):1663-1669.
基金项目:陕西省科学院科技计划项目(2018nk-03);西安市科技计划项目(2020KJRC148)。
作者简介:单萌(1985—),女,辽宁沈阳人,本科,中级工程师。研究方向:食品微生物风险评估。
通信作者:马瑜(1982—),女,陕西西安人,博士,副研究员。研究方向:应用生物技术。

相关热词搜索:
[责任编辑:]

 探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
 《金博宝188官网注册 最佳实践白皮书(2021-2022年)》四大主题发布
《金博宝188官网注册 最佳实践白皮书(2021-2022年)》四大主题发布
 挪帝克开设京东旗舰店 与京东全球购达成战略合作
挪帝克开设京东旗舰店 与京东全球购达成战略合作
 2019《金博宝188官网注册 导刊》杂志订阅返百元红包!
2019《金博宝188官网注册 导刊》杂志订阅返百元红包!
 9月大事 | 市场监管总局开展2018年全国“质量月”活动
9月大事 | 市场监管总局开展2018年全国“质量月”活动
 盒装水果省事不卫生 实验解释3大疑问
盒装水果省事不卫生 实验解释3大疑问
 使用梅特勒-托利多X光机的五大理由
使用梅特勒-托利多X光机的五大理由 小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金
小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金 全球食品创新平台第五期已启动,携手共创安全、健康
全球食品创新平台第五期已启动,携手共创安全、健康





参与评论