高效液相色谱柱后衍生法测定大黄䗪虫丸中的黄曲霉毒素
贺敏才,卢向红,袁邦群
(娄底市食品药品检验检测所,湖南娄底 417000)
摘 要:目的:建立高效液相色谱法测定大黄䗪虫丸中黄曲霉毒素B1、B2、G1、G2的含量,并评价大黄䗪虫丸中黄曲霉毒素的安全性。方法:采用高效液相色谱柱后光化学衍生法,色谱柱为Intersil ODS-3 C18柱,流动相为甲醇-水,梯度洗脱,流速为1.0 mL/min,荧光检测器,激发波长360 nm,发射波长450 nm。结果:黄曲霉毒素B1、B2、G1、G2分别在10.2~51.0 pg(r=0.998 9)、4.3~21.5 pg(r=0.999 6)、10.6~53.0 pg(r=0.998 6)、3.8~19.0 pg(r=0.999 6)范围内,具有良好的线性关系,其加样回收率在83%~94%,RSD为1.56%~2.11%。有9批样品检出黄曲霉毒素,其总含量在0.2657~1.5805 μg/kg。结论:本方法专属性强,操作简单,结果稳定可靠,分离度好,可用于大黄䗪虫丸中黄曲霉毒素的质量控制。
关键词:大黄䗪虫丸;黄曲霉毒素;柱后光化学衍生法;高效液相色谱法
黄曲霉毒素是由黄曲霉和寄生曲霉中产毒菌株产生的一类致癌物质,可诱发肝、肾、肺、胃、结肠等部位的癌变,是目前为止发现的毒性最大的真菌毒素。黄曲霉毒素可以通过多种途径污染食品和饲料,直接或间接地进入食物链,从而威胁人们的健康和生命安全。目前有100多个国家已经制订了食品中黄曲霉的法规标准及检测方法,我国也已于2011年4月20日发布了《 金博宝188官网注册国家标准 食品中真菌毒素限量》(GB 2761—2011),其规定了食品中黄曲霉毒素的限量指标。《中国药典》2005年版增补本收载了黄曲霉毒素的测定方法,并规定了部分品种的限量值[1]。
大黄䗪虫丸是由熟大黄、土鳖虫、水蛭、虻虫、桃仁、炒苦杏仁、黄芩、地黄、白芍、甘草等十二味药经粉碎、过筛和混匀制成的复方制剂。其功效是活血破瘀,通经消癥。常用于瘀血内停所致的癥瘕、闭经,症见腹部肿块、肌肤甲错、面色黯黑、潮热羸瘦、经闭不行[2]。《中国药典》2020年版一部对其中的土鳖虫、水蛭、桃仁的黄曲霉毒素进行了限量控制[2]。目前对大黄䗪虫丸安全性方面的研究尚未见报道,为进一步保证药品的安全性,本试验参照《中国药典》2020年版四部通则2351及有关文献资料[3-9],采用高效液相色谱法柱后衍生法,对大黄䗪虫丸中黄曲霉毒素进行检测,以了解大黄䗪虫丸中黄曲霉毒素污染状况,并为临床安全用药提供数据资料。
1 仪器与方法
1.1 仪器
Waters e2695高效液相谱仪(带自动进样器、柱温箱、荧光检测器、工作站);梅特勒-托利多电子分析天平(千分之一);光化学衍生器Huirentek PHRED-HR;高速匀质机D-500(Madeby Wiggens);离心机TG16G(湖南凯达科学仪器有限公司)。
1.2 试剂
免疫亲和柱(ROMER,AflaStarTM R,Lot:1000004945);黄曲霉毒素混合标准品溶液(中国食品药品检定研究院610001-201602); 甲 醇、 乙 腈 均 为 色 谱 纯; Ⅰ 级 纯 化水(自制);其他试剂均为分析纯。大黄䗪虫丸(批号为20170908、20171112、20171217、20180503、20180810、20181109、20190505、20191202、20191211、20200610,由某制药公司生产)。
1.3 试验方法
1.3.1 色谱条件
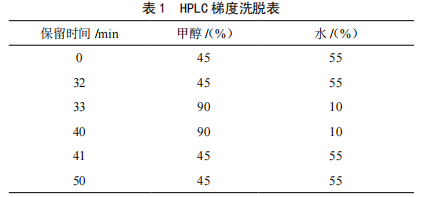
色谱柱:Intersil ODS-3 C18柱(250 mm×4.6 mm,5 μm);柱温:30 ℃;流动相为甲醇-水,梯度洗脱(比例见表1),流速为1.0 mL/min;柱后衍生-光化学衍生法;荧光检测器,激发波长360 nm,发射波长450 nm,进样量20 μL。
1.3.2 溶液制备
(1)混合对照品溶液制备。取黄曲霉毒素混合标准品溶液(黄曲霉毒素B1、B2、G1、G2标示浓度分别为1.02 μg/mL、0.43 μg/mL、1.06 μg/mL、0.38 μg/mL)1.00 mL,加甲醇稀释至50.00 mL,作为储备液,量取储备液1.00 mL,加甲醇稀释至10.00 mL。
(2)供试品溶液制备。取供试品粉末15 g,置均质瓶中,加入氯化钠3 g,精密加入70%甲醇溶液75 mL,高速搅拌2 min(搅拌速度大于11 000 r/min),离心5 min(离心速度4 000 r/min),精密量取上清液15 mL,置50 mL量瓶中,加水稀释至刻度,摇匀,离心5 min(离心速度4 000 r/min),取上清液20.00 mL,通过免疫亲和柱,流速3 mL/min,用20 mL水洗脱,弃去洗脱液,使空气进入柱子,将水挤出柱子,再加2.00 mL甲醇洗脱,收集洗脱液,用甲醇稀释至2.00 mL,摇匀,用微孔滤膜(0.22 μm)滤过,取滤液备用。
(3)阴性样品溶液制备。取检测无黄曲霉毒素的药材,按照药典制法制成大黄䗪虫丸样品,取样品15 g,同供试品方法制备,即得。
2 结果与分析
2.1 系统适应性试验
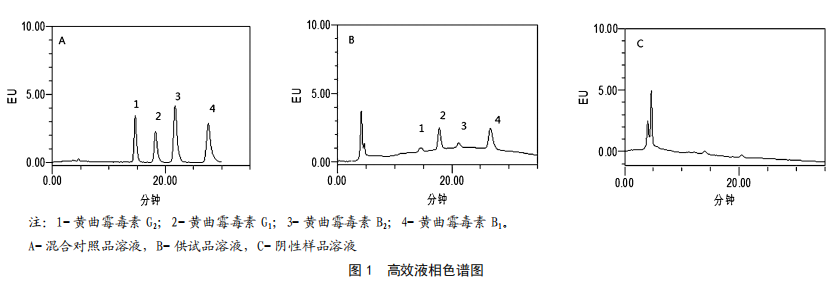
按照1.3.1的色谱条件,分别吸取混合对照品溶液、供试品溶液、阴性样品溶液注入液相色谱仪,记录色谱图(见图1)。由图1可知,黄曲霉毒素各组分完全分离(分离度大于1.5),阴性样品无干扰。
2.2 方法学考察
2.2.1 线性相关性考察
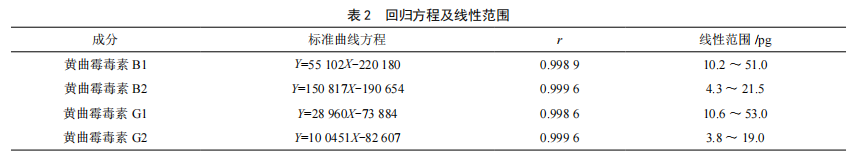
按照1.3.1的色谱条件,精密吸取1.3.2(1)的黄曲霉毒素混合对照品溶液5 μL、10 μL、15 μL、20 μL和25 μL进行测定,记录色谱图,以对照品量为横坐标(X,pg),峰面积为纵坐标(Y),绘制标准曲线,结果见表2
2.2.2 精密度试验
按照1.3.1的色谱条件,吸取混合对照品溶液15 μL,进样6次,测定峰面积,结果表明,黄曲霉毒素B1、B2、G1、G2的RSD分别为2.43%,1.86%,2.99%,2.05%,表明仪器的精密度良好。
2.2.3 稳定性试验
取供试品溶液(批号20191202)1.0mL,加入混合对照品溶液0.10 mL,分别制备2 h、4 h、6 h、12 h、16 h和24 h后,按照1.3.1的色谱条件进行测定,结果表明,黄曲霉毒素B1、B2、G1、G2的RSD分别为2.03%,1.98%,2.69%,2.32%,表明供试品溶液在24 h内测定稳定。
2.2.4 重复性试验
取样品(批号20180810),按1.3.2(2)的方法,制备6份供试品溶液,按照1.3.1的色谱条件进行测定。结果表明,黄曲霉素B1的RSD为3.02%,黄曲霉毒素总量的RSD为4.12%,表明该方法重复性良好。
2.2.5 加样回收率试验
精密称取未检出黄曲霉毒素的样品约7.5 g(批号20181109),6份,分别加入1.3.2(1)的黄曲霉毒素混合对照品溶液储备液0.10 mL,按照1.3.2(2)的方法制备,按照1.3.1的色谱条件进行测定,计算黄曲霉毒素的RSD和回收率。结果表明,黄曲霉毒素B1、B2、G1、G2的平均回收率分别为94%,86%,89%,83%;RSD分别为1.89%,1.56%,2.11%,2.03%(n=6)。
2.2.6 检测限和定量限试验
倍比稀释混合对照品溶液,在信噪比约为3时,测得黄曲霉毒素B1、B2、G1、G2的检测限分别为0.408 pg,0.172 pg,0.424 pg,0.152 pg;在信噪比约为10时,测得黄曲霉毒素B1、B2、G1、G2的定量限分别为1.346 pg,0.585 pg,1.421 pg,0.519 pg。
2.2.7 样品含量测定
取10批次样品,按照1.3.2(2)的方法制备供试品溶液,按照1.3.1的色谱条件进行测定,结果见表3。

3 结论
①本试验中,曾按《中国药典》一部方法选用甲醇-乙腈-水(40∶1842)作为流动相,分离效果不理性,样品中其他成分干扰大,最后选用甲醇-水为流动相进行梯度洗脱,各黄曲霉毒素峰分离效果好,其他成分无干扰。②对10批次样品进行检测,其中有9批中有黄曲霉毒素的检出,结果黄曲霉毒素B1的含量均少于1 μg/kg,黄曲霉毒素的总量均小于2 μg/kg,都低于药典规定的限度值(5 μg/kg,10 μg/kg)。表明大黄䗪虫丸安全性较好,但检出率高到90%,仍应重视黄曲霉毒素的检测。③本方法具有专属性强,操作简单,结果稳定可靠,分离度好等特点,可作为用于大黄䗪虫丸中黄曲霉毒素的含量测定的方法。④大黄䗪虫丸中的熟大黄、桃仁、炒苦杏仁、甘草等及主要辅料蜂蜜,有的属于药食同源,有的可用于保健食品。而本次试验中黄曲霉毒素的检出率极高,相关部门应反思其原料的安全性,尤其上述广泛作为食品使用的药材,进而保证广大消费者的饮食用药安全。
参考文献
[1]国家药典委员会.中国药典分析检测技术指南[M].北京:中国医药科技出版社,2017.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2020.
[3]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2020.
[4]刘丽娜,李耀磊,金红宇,等.免疫亲和净化HPLC柱后光化学衍生荧光法测定动物药中黄曲霉毒素[J].中草药,2017,48(6):1220-1224.
[5]黄晓燕,方磊,李荣玮,等.HPLC法测定小儿扶脾颗粒中黄曲霉毒素B1、B2、G1、G2含量[J].中国药师,2018,21(2):334-336.
[6]栗建明,顾利红,隆颖.高效液相色谱柱后衍生法测定归脾丸中的黄曲霉毒素[J].今日药学,2017,27(7):460-462.
[7]刘书宇,仇峰,杨美华.免疫亲和柱净化-在线柱后光化学衍生HPLC-FLD检测莲子中黄曲霉毒素B1、B2、G1、G2及其液质确认[J].中国中药杂志,2012,37(3):305-309.
[8]宋晓宁,张志勇.香砂六君丸中的黄曲霉毒素B1、B2、G1、G2的含量测定及安全性评价[J].时珍国医国药,2014,25(9):2252-2253.
[9]魏莹,李文东,杨兰,等.高效液相色谱法柱后衍生法测定陈皮中黄曲霉毒素[J].中国药业,2015,24(24):160-162.
作者简介:贺敏才(1983—),女,湖南双峰人,本科,主管中药师。研究方向:食品药品检验工作与质量标准。

相关热词搜索:
[责任编辑:]

 挪帝克开设京东旗舰店 与京东全球购达成战略合作
挪帝克开设京东旗舰店 与京东全球购达成战略合作
 2019《金博宝188官网注册 导刊》杂志订阅返百元红包!
2019《金博宝188官网注册 导刊》杂志订阅返百元红包!
 9月大事 | 市场监管总局开展2018年全国“质量月”活动
9月大事 | 市场监管总局开展2018年全国“质量月”活动
 盒装水果省事不卫生 实验解释3大疑问
盒装水果省事不卫生 实验解释3大疑问
 “食安中国网”手机站上线通知
“食安中国网”手机站上线通知
 食安中国网关于2015年春节放假的通知
食安中国网关于2015年春节放假的通知
 小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金
小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金 全球食品创新平台第五期已启动,携手共创安全、健康
全球食品创新平台第五期已启动,携手共创安全、健康 金博宝188官网注册 新动向讲座:权威解读金博宝188官网注册 中的过敏原问
金博宝188官网注册 新动向讲座:权威解读金博宝188官网注册 中的过敏原问 【采访ADM】力行不辍、多元发展,满足消费者的营养
【采访ADM】力行不辍、多元发展,满足消费者的营养 食品掺假与成分检测网络研讨会
食品掺假与成分检测网络研讨会





参与评论