水生软体动物中氯霉素的测定
陈 磊
(马鞍山市市场监管综合行政执法支队,安徽马鞍山 243000)
摘 要:本文建立液相色谱配备三重四级杆质谱仪测定水生软体动物中氯霉素的检测方法。样品经Na2EDTA-Mcllvaine缓冲液提取,HLB固相萃取柱净化,采用C18色谱柱(2.1 mm×100 mm,1.8 μm),以乙腈和10 mmol/L乙酸铵水溶液为流动相进行梯度洗脱,电喷雾负离子多反应监测模式对氯霉素进行定性、定量测定。在线性范围0.1~10.0 ng/mL范围内,检出限为0.10 μg/kg,平均回收率为73.3%~95.0%,相对标准偏差为0.62%~1.50%。建立此方法可实现对水生软体动物中氯霉素的高效检测。(马鞍山市市场监管综合行政执法支队,安徽马鞍山 243000)
关键词:液相色谱;三重四级杆质谱仪;水生软体动物;氯霉素
氯霉素是一种广谱抗菌药物,由Ehrlichz在1947年首次分离得到[1]。氯霉素不仅对多数革兰氏阳(阴)性菌有很好的抑制作用,而且对沙门氏菌病和大肠杆菌病有很好的治疗作用,因此在疾病的预防和治疗方面得到了广泛的应用[2-3]。但随着广泛应用后发现,氯霉素可导致人类再生障碍性贫血、粒细胞缺乏病、灰婴综合症、溶血性贫血等,具有毒副作用[4-5]。当前许多国家在食品生产环节都禁止使用氯霉素,我国农业部于2019年颁布第250号公告《金博宝188官网注册国家标准食品中兽药最大残留量》中规定氯霉素在动物源性食品中不得检出[6-7]。目前现行有效的氯霉素检测标准中样品处理的步骤烦琐,试剂耗材使用量大,因此本文提出一种高效、准确、环保的方法来检测氯霉素。
1 材料与方法
1.1 仪器与试剂
1.1.1 实验仪器
AB 3500型液相色谱配备三重四级杆质谱仪(美国,SCIEX);ME204/02型万分之一天平(瑞士,梅特勒-托利多);Arium-Pro型纯水系统(德国,赛多利斯);S-700B型多参数测试仪(瑞士,梅特勒-托利多);T18型分散机(德国,IKA);0.22 μmPTFE微孔滤膜(德国,CNW);HC-3018型离心机(中国,中科中佳);HLB固相萃取柱(60 mg/3 mL)(美国,waters);24位固相萃取装置(德国,CNW);N-EVAP 5085型氮吹仪(美国,Organomation Associates)。
1.1.2 实验试剂
氯霉素、D5-氯霉素均由德国Dr.Ehrenstorfer公司提供;乙腈(LC-MS级,默克);甲酸(LC-MS级,TCI);甲醇(LC-MS级,默克);乙酸乙酯(色谱纯,TEDIA);氨水(优级纯,国药);柠檬酸(分析纯,阿拉丁);磷酸氢二钠(分析纯,阿拉丁);氢氧化钠(分析纯,国药);乙二胺四乙酸二钠(分析纯,国药);实验室用水均为超纯水。
1.1.3 试剂配制
①Na2EDTA-Mcllvaine缓冲溶液。称取柠檬酸12.9 g,磷酸氢二钠10.9 g,乙二胺四乙酸二钠37.2 g,加水900 mL溶解,用1 mol/L氢氧化钠调pH至4.0±0.5,加水定容至1 000 mL。②氯霉素标准储备液(100 μg/mL)。准确称取0.01 g的氯霉素标准物质,用乙腈配制成 100 μg/mL标准储备液。③氯霉素标准中间液(10 μg/mL):移取1 mL 的氯霉素标准储备液,用乙腈配制成10 μg/mL标准储备液。④D5-氯霉素标准储备液(100 μg/mL)。准确称取0.01 g 的D5-氯霉素标准物质,用乙腈配制成100 μg/mL标准储备液。
⑤D5-氯霉素标准中间液(1 μg/mL)。移取1 mL 的D5-氯霉素标准储备液,用乙腈配制成1 μg/mL标准储备液。
⑥D5-氯霉素标准工作液(0.1 μg/mL)。移取1 mL 的D5-氯霉素标准中间液,用乙腈配制成0.1 μg/mL标准储备液。⑦氯霉素标准工作液。分别移取0.01 ml、0.05 mL、0.10 mL、0.50 mL、1.00 mL 的氯霉素中间液和1 mLD5-氯霉素标准工作液至10 mL容量瓶中,并用初始流动相定容至刻度配制浓度为0.1 ng/mL、0.5 ng/mL、1.0 ng/mL、5.0 ng/mL和10.0 ng/mL,的工作液,混匀。
1.2 色谱条件与质谱条件
1.2.1 色谱条件
月旭Ultimate C18色谱柱(2.1 mm×100 mm,1.8 μm);柱温:30 ℃;流速:0.3 mL/min;进样量:2 μL;流动相:10 mmol/L乙酸铵水溶液(A)和乙腈(B);梯度洗脱程序见表1。
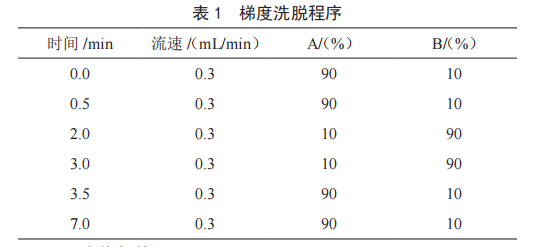
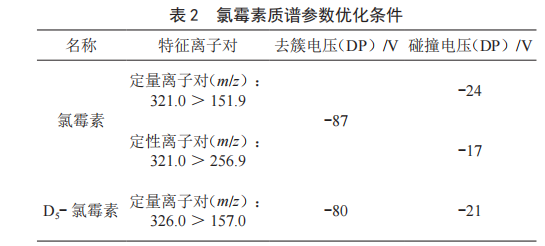
电喷雾电离源(ESI);负离子扫描,多反应监测(MRM);离子源温度(TEM):550 ℃;电喷雾电压:-4 500 V;气帘气:35 psi;喷雾气(GS1):55 psi;辅助加热气(GS2):55 psi;其他质谱条件见表2。
1.3 实验方法
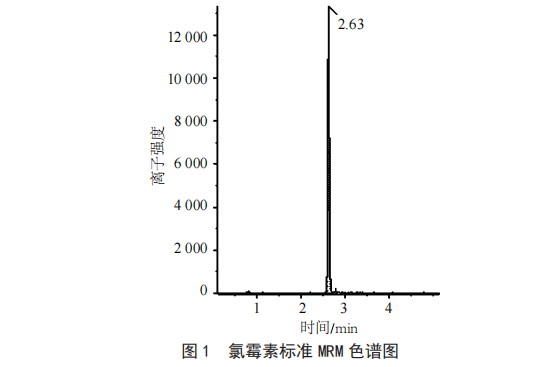
称取2.0 g(精确至0.1 mg)置于50 mL离心管中加入100 μL,20 mLNa2EDTA-Mcllvaine缓冲溶液,10 000 r/min匀浆提取1 min,10 000 r/min离心5 min,取上清液以2 mL/min的速度过HLB固相萃取柱(使用前分别用6 mL甲醇和6 mL水活化),待试样完全流出后,依次用8 mL水和5 mL甲醇水溶液(甲醇∶水体积比为1∶19)淋洗,弃去全部流出液,抽干,用8 mL甲醇洗脱,在40 ℃水浴下氮气吹至近干,用2 mL初始流动相复溶,过0.22 μmPTFE滤膜,待上机测试。氯霉素测试结果见图1。
2.1 提取液的选择
本文分别选用乙腈-Mcllvaine、碱化乙酸乙酯以及Na2EDTA-Mcllvaine缓冲溶液作为提取液,对氯霉素进行提取。发现这3种提取液对氯霉素的提取效率没有明显差异,为减少有机试剂的使用量,本文最终选择了Na2EDTA-Mcllvaine缓冲溶液为提取液。
2.2 固相萃取柱的选择
HLB固相萃取柱中的填料是由亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮两种单体按一定比例聚合成的大孔共聚物,其对非极性至中等极性的酸性、中性、碱性目标化合物均有高而稳定的回收率。即使柱床干涸,回收率也不受影响。相同规格下HLB固相萃取柱的柱容量是传统C18固相萃取柱的3倍。因此选用HLB固相萃取柱进行样品
分析。
2.3 工作曲线和检出限
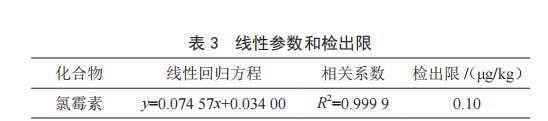
按照实验方法,对浓度分别为0.1 ng/mL、0.5 ng/mL、1.0 ng/mL、5.0 ng/mL和10.0 ng/mL标准系列溶液进行测定,以氯霉素的质量浓度为横坐标,与其对应的峰面积为纵坐标绘制工作曲线。结果表明,氯霉素的质量浓度与其对应的峰面积之间呈线性关系。线性回归方程和相关系数见表3。将混标添加在空白基质样品中,在相同条件下进行6次平行试验,按照3倍信噪比考察了氯霉素的检出限(见表3)。
分别称取4种水生软体动物阴性样品2.0 g(精确至
0.1 mg),按照实验方法对其进行不同浓度水平的加标回收试验,每个浓度平行进行6次实验,计算回收率,结果见表4。
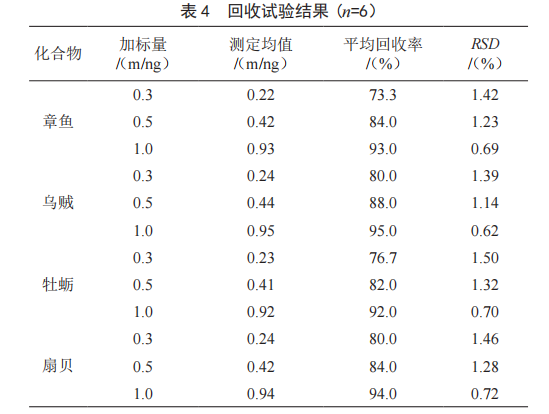
本文建立了Na2EDTA-Mcllvaine缓冲溶液为提取液,连用HLB固相萃取柱净化的方法对市售水生软体动物进行前处理,使用液相色谱联用三重四级杆质谱仪测定氯霉素。该方法操作简便、准确度高,经济适用型好,分离度符合要求,适合软体动物中氯霉素的定性和定量分析,为水生软体动物的市场监管提供了有力的技术支持。
参考文献
[1]KIKUCHI H,SAKAI T,NEMOTO S,et al.Total determination of residual flut-olanil and its metabolites in livestock products and seafood using liquid chromato-graphy-tandem spectrometry[J].Food Additives and Contaminants:Part A,2018,35(12):12366-92374.
[2]梅英杰,史新宇,董瑾,等.超高效液相色谱-串联质谱法同时检测鸡肉中氯霉素、四环素、金霉素和土霉素[J].食品与发酵工业,2017,43(8):240-245.
[3]李晓晶,潘幼娴,于鸿,等.固相萃取-超高效液相色谱-串联质谱法测定水中氯霉素、氟甲砜霉素和4种四环素类抗生素[J].中国卫生检疫杂志,2013,23(11):2426-2428.
[4]王安伟,刘天密,萆锐,等.水产品中氯霉素残留检测方法研究进展[J].金博宝188官网注册质量检测学报,2017,8(11):4259-4264.
[5]崔荣飞,赵兴鑫,田梅,等.动物源性食品中非法添加物残留危害及检测技术[J].今日畜牧兽医,2019,35(12):1-3.
[6]国务院.中华人民共和国国务院令第404号《兽药管理条例》[EB/OL].(2004-04-09)[2021-04-13].http://www.gov.cn/zhengce/content/
2008-03/28/content_3051.htm.
[7]农业部.动物性食品中兽药最高残留限量(中华人民共和国农业部第235号)[EB/OL].(2002-12-24)[2021-04-12].http://www.eshian.com/laws/17195.html.

相关热词搜索:
[责任编辑:]

 挪帝克开设京东旗舰店 与京东全球购达成战略合作
挪帝克开设京东旗舰店 与京东全球购达成战略合作
 2019《金博宝188官网注册 导刊》杂志订阅返百元红包!
2019《金博宝188官网注册 导刊》杂志订阅返百元红包!
 9月大事 | 市场监管总局开展2018年全国“质量月”活动
9月大事 | 市场监管总局开展2018年全国“质量月”活动
 盒装水果省事不卫生 实验解释3大疑问
盒装水果省事不卫生 实验解释3大疑问
 “食安中国网”手机站上线通知
“食安中国网”手机站上线通知
 食安中国网关于2015年春节放假的通知
食安中国网关于2015年春节放假的通知
 金博宝188官网注册 新动向讲座:权威解读金博宝188官网注册 中的过敏原问
金博宝188官网注册 新动向讲座:权威解读金博宝188官网注册 中的过敏原问 【采访ADM】力行不辍、多元发展,满足消费者的营养
【采访ADM】力行不辍、多元发展,满足消费者的营养 食品掺假与成分检测网络研讨会
食品掺假与成分检测网络研讨会 权威专家解读食品中的丙烯酰胺及含量控制措施,快来
权威专家解读食品中的丙烯酰胺及含量控制措施,快来 专家齐聚第三届全球金博宝188官网注册 共治论坛,启动金博宝188官网注册
专家齐聚第三届全球金博宝188官网注册 共治论坛,启动金博宝188官网注册





参与评论