固相萃取-高效液相色谱-二极管阵列检测法测定饮料中9种人工合成着
固相萃取-高效液相色谱-二极管阵列检测法测定饮料中9种人工合成着色剂
□ 汪强 黄宇 张月松 赵嵩 马鞍山市食品药品检验中心
摘 要:本文介绍了使用固相萃取-高效液相色谱-二极管阵列检测技术来简便快捷地检测饮料中柠檬黄、新红、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、赤藓红这9种人工合成着色剂含量的方法。样品经PWAX固相萃取柱净化,采用串联两根Thermo BDS C18色谱柱(4.6×150mm,5μm),以甲醇和0.02mol/L乙酸铵溶液为流动相进行梯度洗脱,DAD检测波长为254nm,以保留时间和待测物的紫外吸收光谱进行定性分析、外标法进行定量分析。结果显示,9种人工合成着色剂的线性范围为0.5~50mg/L(r2>0.999),检出限为0.11~0.39mg/kg,平均回收率为81.5%~102.2%,相对标准偏差为0.23%~2.24%。结论为,该方法可实现对饮料中9种合成着色剂的同时检测,具有快捷、准确、灵敏的特点。
关键词:固相萃取 高效液相 人工合成着色剂 饮料
在现代食品工业中,各种食品添加剂被频繁使用。其中,人工合成着色剂具有色泽鲜艳、着色能力强、性质稳定、价格低廉等特点,因而在各式饮料、糕点等的配料表中频频“曝光”。殊不知,五彩斑斓的人工合成着色剂主要以苯、甲苯、萘等芳香族化工产品为主要原料,经过磺化、卤化、偶氮化等有机反应合成而来,过量摄入人工合成着色剂会对人体造成损害[1-3]。因此,《金博宝188官网注册 国家标准 食品添加剂使用标准》(GB 2760-2014)[4]中对柠檬黄、新红、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、赤藓红这9种人工合成着色剂的使用范围及最大使用量作出了明确规定。为了避免企业超量使用或超范围使用人工合成着色剂,故需要通过简单、快捷的检测手段对市场上流通的产品进行监管。
目前,人工合成着色剂的检测方法主要有高效液相色谱法、液相色谱-质谱联用法、薄层色谱法、毛细管电泳法等[5-9]。其中,高效液相色谱法由于仪器保有量大、灵敏度高、操作简单等特点而被广泛应用。GB 5009.35-2016[10]、GB 5009.141-2016[11]及SN/T 1743-2006[12]中规定的食品中合成着色剂检测方法均为高效液相色谱法,但其前处理方法都是聚酰胺吸附法或液-液分配法——操作复杂、消耗试剂多。因此,本试验采用PWAX固相萃取小柱[13]对饮料进行前处理,使用高效液相色谱-二极管阵列检测器于254nm波长下同时测定柠檬黄、新红、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、赤藓红这9种人工合成着色剂。该方法能够显著提高检测效率,降低成本。
1 实验部分
1.1 仪器与试剂
1.1.1 仪器
LC-20AT型高效液相色谱仪(配DAD检测器),岛津(日本);24位固相萃取装置,安谱(中国);ME204/02型万分之一天平,梅特勒-托利多(瑞士);12位N-EVAP 5085型氮吹仪,organomation(美国);Arium-Pro型纯水系统,赛多利斯(德国);S-700B型多参数测试仪,梅特勒-托利多(瑞士),Cleanert PWAX(150mg/6mL),Agela(中国);0.45μm水洗微孔滤膜,CNW(德国),HC-3018型离心机,中科中佳(中国)。
1.1.2 试剂
柠檬黄、新红、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、赤藓红这9种着色剂标准物质,均由德国Dr.Ehrenstorfer公司提供,并于20±4℃下保存。
甲醇(色谱纯),TEDIA;乙酸铵(色谱纯),阿拉丁;氨水(分析纯)、柠檬酸(分析纯)、硫酸锌(分析纯),国药;实验室用水均为超纯水。
乙酸铵溶液(0.02mol/L):称取1.54g乙酸铵,加水溶解并稀释至1000mL。
柠檬酸溶液(200g/L):称取20g柠檬酸,加水定容至100mL溶解,混匀。
硫酸锌溶液(120g/L):称取12g硫酸锌,加水定容至100mL溶解,混匀。
2%氨化甲醇:量取2mL氨水,加甲醇定容至100mL,混匀。
水(pH值6.0):水加柠檬酸溶液调节至pH值6.0。
柠檬黄、新红、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、赤藓红标准混合储备液(1mg/mL):分别称取适量的9种着色剂置于烧杯中,用少许水(pH值6.0)溶解,转移至100mL容量瓶中,并用水(pH值6.0)定容至刻度,混匀。
1.2 色谱条件
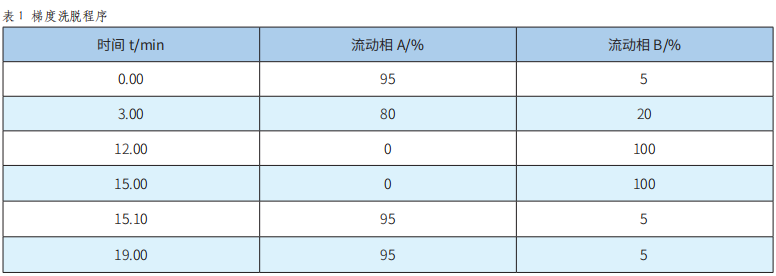
两根串联的Thermo BDS C18色谱柱(4.6×150mm,5μm);柱温:35℃;流量:1.0mL/min;进样量:50μL;检测波长:254nm;流动相A:0.02mol/L乙酸铵溶液,流动相B:甲醇;梯度洗脱程序见表1。
1.3 实验方法
1.3.1 不含蛋白质的样品
称取10g样品放入100mL烧杯中(含二氧化碳的样品超声去除二氧化碳),用柠檬酸溶解调节pH值至6.0,然后加入到分别用8mL甲醇、8mL水(pH值6.0)进行活化的PWAX小柱中。烧杯用适量的水冲洗后一起加入至PWAX小柱,再用6mL水(pH值6.0)、6mL甲醇淋洗,之后通入空气吹干小柱6min。最后,用8mL 2%氨化甲醇洗脱并接收,收集液于50℃氮气吹干,用5mL水(pH值6.0)定容,过0.45μm水系微孔滤膜,待测。
1.3.2 含蛋白质的样品
称取10g样品放入50mL离心管中,加入5mL硫酸锌溶液(120g/L),用柠檬酸溶解调节pH值至6.0,在10000r/min下离心5min,取上清液于干净的50mL离心管中。残渣中加入5mL水(pH值6.0)涡旋振荡提取5min,在10000r/min下离心,取上清液合并至上述干净的50mL离心管中。将合并后的上清液加入至分别用8mL甲醇、8mL水(pH值6.0)进行活化的PWAX小柱中,再用6mL水(pH值6.0)、6mL甲醇淋洗,之后通入空气吹干小柱6min。最后,用8mL 2%氨化甲醇洗脱并接收,收集液于50℃氮气吹干,用5mL水(pH值6.0)定容,过0.45μm水系微孔滤膜,待测。
2 结果与讨论
2.1 净化方法的改进
《金博宝188官网注册 国家标准 食品中合成着色剂的测定》(GB 5009.35-2016)[10]规定,同时测定赤藓红含量时需要使用液-液分配法,但该方法不仅操作步骤繁琐,且使用的试剂量较多、对环境危害大。所以本文选用PWAX小柱代替原有国标的测试方法,不仅简化了操作步骤,还减少了污染,更可同时检测9种着色剂。
2.2 流动相的改进
流动相的选择参考国标《金博宝188官网注册 国家标准 食品中合成着色剂的测定》(GB 5009.35-2016)[10]方法,采用甲醇和0.02mol/L乙酸铵的混合体系,优化梯度洗脱条件以缩短9种着色剂的检测时间,并获得了较好的分离效果,梯度洗脱程序见表1。
2.3 色谱柱的改进
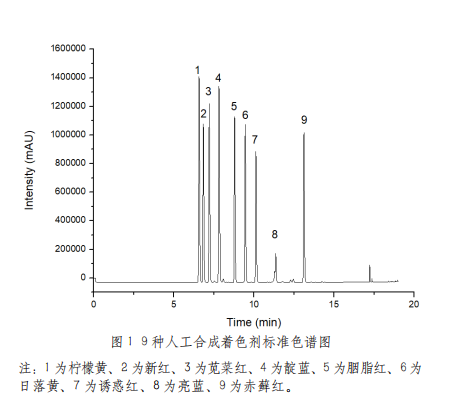
当前,市面上C18色谱柱的常见规格为(4.6×150mm,5μm)和(4.6×250mm,5μm)两种。在优化后的色谱条件下,对比市面上两种常见规格C18色谱柱的分离效果发现,柠檬黄和新红这两种着色剂的分离效果并不理想。为了能将这两种着色剂完全分离,于是根据增加柱长可以提高分离效果的原理,将两根规格(4.6mm×150mm,5μm)的C18色谱柱通过管路连接起来形成一根规格类似为(4.6mm×300mm,5μm)的C18色谱柱,再使用优化后的色谱条件分离9种着色剂,发现9种色素均能够完全分离,见图1。因此,选择串联相同规格色谱柱作为分离目标化合物的新方法。
2.4 检测波长的选择
在检测多种着色剂时,很多文章报道是通过在不同着色剂的出峰时间段内设置其最大吸收波长的方式来进行检测。这种方式虽然可以增加检测的灵敏度,但由于不断的改变波长造成在检测低浓度时基线波动较大,使检测数据不准确。因此,本文选择使用254nm作为9种着色剂的检测波长。此外,为了提升检测灵敏度,本文通过增加进样量的方式来改善这一问题。
2.5 工作曲线和检出限
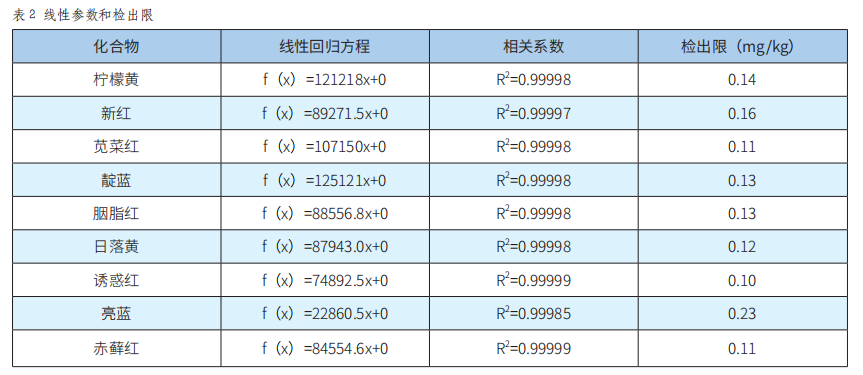
按照实验方法对不同浓度标准系列溶液进行测定,以9种着色剂的质量浓度为横坐标,与其对应的峰面积为纵坐标绘制工作曲线。结果表明,9种着色剂的质量浓度均在0.5~50mg/L内,与其对应的峰面积之间呈线性关系,线性回归方程及相关系数见表2。
将混标添加在空白基质样品中,在相同条件下进行6次平行试验,按照3倍信噪比考察了9种着色剂的检出限,具体结果见表2。
2.6 回收试验
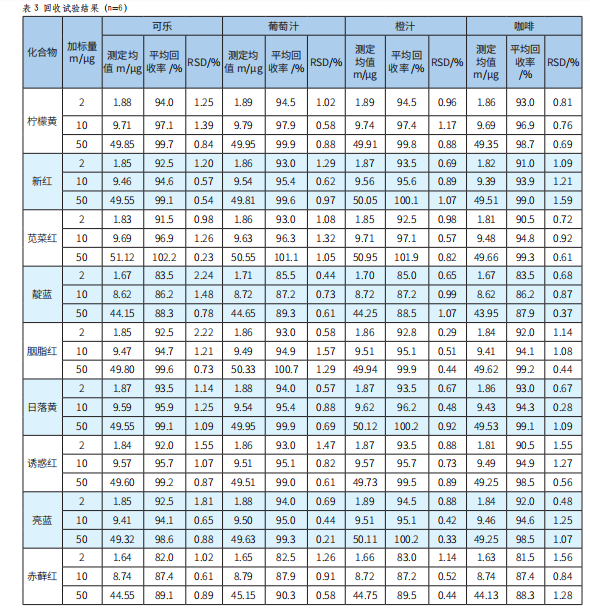
分别称取可乐、葡萄汁、橙汁、咖啡这4种阴性样品10.00g,按照实验方法对其进行不同浓度水平的加标回收试验,每一个浓度平行进行6次试验,计算回收率,结果见表3。
3 结果与讨论
本文建立了采用PWAX固相萃取小柱对饮料进行前处理,使用高效液相色谱-二极管阵列检测器于254nm波长下同时测定柠檬黄、新红、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、赤藓红这9种人工合成着色剂的方法。该方法操作简便、基体干扰小,优化后的色谱条件出峰快、峰形好,分离度符合要求,适合饮料产品中着色剂的定性和定量分析。
参考文献:
[1] 李帮锐,冯家力,潘振球,等. 高效液相色谱-质谱联用法测定饮料中的人工合成色素[J].中国卫生检验杂志,2007,17(4):579-580.
[2] 张学忠,牛之瑞,冯雷,等.高效液相法测定饮料中合成着色剂预处理方法的比较[J].食品研究与开发,2011,32(2):94-96.
[3] 朱海英,黄万琪. 金博宝188官网注册 法背景下合成色素的问题及对策[J]. 现代医药卫生,2011,27(8):1259−1261.
[4] 《金博宝188官网注册 国家标准 食品添加剂使用标准》(GB 2760-2014)[S].
[5] 谭慧,王胜,朱其名. 高效液相色谱法同时测定熟肉制品中的10种合成色素[J]. 中国卫生检验杂志,2014,24(16):2334−2336.
[6] 伊雄海,邓晓军,杨惠琴,等. 液相色谱-串联质谱法检测食品中的多 种易滥用着色剂[J]. 色谱,2011,29(11):1062−1069.
[7] 龙巍然,王兴益,史振雨,等. 胶束电动毛细管色谱同时测定食品中13种人工合成色素[J]. 分析测试学报,2012,31(9):1100–1104.
[8] Andrade FI,Florindo GMI,Pinto VIG, et al. Determination of synthetic food dyes in commercial soft drinks by TLC and ion-pair HPLC [J]. Food Chem, 2014, 157:193−198.
[9] 林慧,徐春祥,刘成志,等. 液相色谱-串联四极杆飞行时间质谱快速筛查食品中违禁着色剂[J]. 金博宝188官网注册 质量检测学报,2017,8(4):1389−1396.
[10]《金博宝188官网注册 国家标准 食品中合成着色剂的测定》(GB 5009.35-2016)[S].
[11]《金博宝188官网注册 国家标准 食品中诱惑红的测定》(GB 5009.141-2016)[S].
[12]《食品中诱惑红、酸性红、亮蓝、日落黄的含量检测 高效液相色谱法》(SN/T 1743-2006)[S].
[13] 胡贝,李丽霞,刘红等. SPE-HPLC法测定食品中8种合成着色剂[J]. 食品工业,2020,41(1):298-301.

相关热词搜索:
[责任编辑:]

 挪帝克开设京东旗舰店 与京东全球购达成战略合作
挪帝克开设京东旗舰店 与京东全球购达成战略合作
 2019《金博宝188官网注册
导刊》杂志订阅返百元红包!
2019《金博宝188官网注册
导刊》杂志订阅返百元红包!
 9月大事 | 市场监管总局开展2018年全国“质量月”活动
9月大事 | 市场监管总局开展2018年全国“质量月”活动
 盒装水果省事不卫生 实验解释3大疑问
盒装水果省事不卫生 实验解释3大疑问
 “食安中国网”手机站上线通知
“食安中国网”手机站上线通知
 食安中国网关于2015年春节放假的通知
食安中国网关于2015年春节放假的通知
 食品掺假与成分检测网络研讨会
食品掺假与成分检测网络研讨会
 权威专家解读食品中的丙烯酰胺及含量控制措施,快来
权威专家解读食品中的丙烯酰胺及含量控制措施,快来
 专家齐聚第三届全球金博宝188官网注册
共治论坛,启动金博宝188官网注册
专家齐聚第三届全球金博宝188官网注册
共治论坛,启动金博宝188官网注册
 中国国际金博宝188官网注册
与质量控制会议
中国国际金博宝188官网注册
与质量控制会议
 全球金博宝188官网注册
创新平台第四期入围项目名单揭晓,37个
全球金博宝188官网注册
创新平台第四期入围项目名单揭晓,37个






参与评论